Dano gastrointestinal agrava a febre amarela
Pesquisadores da USP e da Universidade de Wisconsin-Madison constataram que hemorragia no intestino durante a progressão de casos graves da doença causa infecção sistêmica
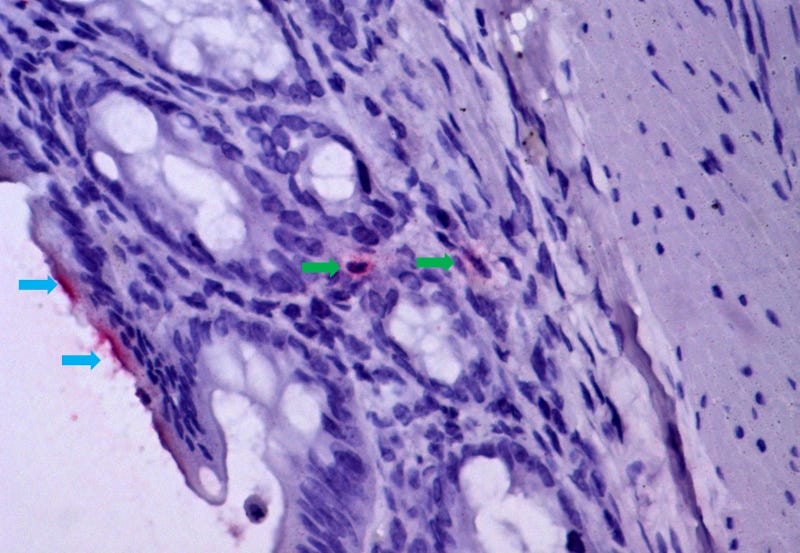
Mucosa intestinal de hamster infectado pelo vírus da febre amarela, demonstrando isquemia e translocação bacteriana, mecanismo de passagem de bactérias e seus produtos (marcados em vermelho, por imunohistoquímica) do lúmen intestinal (setas azuis) para a mucosa intestinal (setas verdes), atingindo a corrente sanguínea. O mesmo mecanismo de lesão ocorre em humanos com febre amarela fatal (imagem: Amaro Nunes Duarte Neto/HC-FM-USP)
Além de afetar principalmente o fígado e, por isso, ser considerada uma doença hepática, a febre amarela atinge, em sua fase aguda, diversos outros órgãos, como rins, coração, cérebro e pulmões.
Um estudo conduzido por pesquisadores das universidades de São Paulo (USP) e de Wisconsin-Madison (Estados Unidos) apontou que, durante a progressão dos casos graves da doença – nos quais surgem complicações que podem levar à morte –, ocorre também hemorragia na mucosa do intestino. Esse dano gastrointestinal permite que bactérias do interior do órgão entrem na corrente sanguínea e atinjam o fígado, causando uma infecção sistêmica generalizada – a sepse –, que agrava o quadro clínico inicialmente causado pelo vírus.
Os resultados do trabalho, apoiado pela FAPESP, sugerem que o dano gastrointestinal é um fator-chave que diferencia casos fatais de tratáveis e pode guiar novas estratégias de tratamento focadas na prevenção da sepse bacteriana. As descobertas foram descritas em artigo publicado no Journal of Infectious Diseases.
“Observamos que a baixa de suprimento sanguíneo no intestino, que chamamos de isquemia mesentérica, acaba levando à passagem de produtos bacterianos do órgão – que possui a maior concentração da microbiota humana – para o sangue dos pacientes que desenvolveram a forma mais grave de febre amarela”, diz à Agência FAPESP Esper Kallás, professor da Faculdade de Medicina (FM) da USP e um dos autores do estudo.
“Isso acaba gerando um aumento de neutrófilos no sangue [tipo de glóbulo branco que constitui a primeira linha de defesa contra bactérias e fungos]”, explica o pesquisador, que também é diretor do Instituto Butantan.
O enigma dos neutrófilos
O pesquisador e colaboradores, vinculados ao Laboratório de Alergia e Imunopatologia Clínica da FM-USP, já haviam observado que pacientes com febre amarela e aumento do número de neutrófilos apresentavam maior mortalidade. A descoberta intrigou o grupo, pois os neutrófilos são comumente associados à resposta imunológica a infecções bacterianas, enquanto a febre amarela é uma doença viral (leia mais em: agencia.fapesp.br/56901).
Para investigar as causas dessa neutrofilia, em 2020, iniciaram um estudo com pacientes que tiveram a forma mais grave da doença. “Uma das hipóteses levantadas foi que a própria cascata inflamatória podia levar à neutrofilia. Outra possibilidade seria um reflexo de alteração medular induzida pelo vírus, mas isso não se encaixava bem”, conta Kallás.
A hipótese mais plausível foi a de que a neutrofilia seria causada por um processo inflamatório desencadeado no intestino em razão de uma isquemia. As bactérias estariam cruzando a barreira intestinal e entrando na corrente sanguínea, causando uma inflamação acentuada que piorava o quadro e levava ao óbito.
Marcador biológico
A fim de identificar potenciais marcadores biológicos associados a esse processo de translocação bacteriana, o pesquisador Mateus Vailant Thomazella, sob orientação de Kallás, analisou, com bolsa da FAPESP, amostras do plasma de 90 pacientes com quadro grave internados nos hospitais das Clínicas e Emílio Ribas entre 2018 e 2019, dos quais 27 vieram a óbito.
A varredura no plasma sanguíneo dos pacientes que morreram indicou que a I-FABP (sigla em inglês de proteína ligadora de ácidos graxos intestinal) desempenha um papel importante no prognóstico da doença, atuando como um biomarcador específico para danos intestinais. As concentrações plasmáticas de I-FABP foram significativamente mais elevadas em casos fatais.
“O I-FABP é um marcador muito associado à lesão de enterócitos, células que constituem a mucosa intestinal. Quando ocorrem danos nessa mucosa, os níveis dessa proteína aumentam no plasma”, explica Thomazella.
Observações em autópsias
O dano na mucosa intestinal também vinha sendo observado por Amaro Nunes Duarte, professor do Departamento de Patologia da FM-USP. Ao conduzir autópsias durante a epidemia em São Paulo (2018-2019), Duarte notou hemorragia na parede intestinal e isquemia do leito esplâncnico – a rede de vasos que supre os órgãos abdominais.
“Inicialmente, essas observações foram tratadas como impressões anatômicas do patologista, mas ao analisar as lâminas constatei lesão vascular nos intestinos e no estômago, característica da falta de irrigação. A lesão vascular da mucosa gastrointestinal permite a passagem de bactérias do lúmen intestinal para o sangue e o fígado, agravando o dano inicial pelo vírus da febre amarela e levando ao óbito”, explica Duarte.
Para validar os achados, os pesquisadores da USP associaram-se ao professor Adam Bailey, da Universidade de Wisconsin-Madison, que desenvolveu um modelo experimental de hamster infectado pelo vírus. As análises dos tecidos animais evidenciaram um quadro semelhante ao humano, com hemorragias e trombos na parede intestinal.
“A entrada de bactérias no sangue dos animais mostrou que a translocação é um mecanismo progressivo na evolução da febre amarela grave”, afirma Duarte. Os pesquisadores pretendem agora analisar amostras de pulmões de pacientes fatais para entender os efeitos dessa translocação no órgão.
O artigo Mesenteric ischemia and bacterial translocation precipitate the intoxication phase of yellow fever pode ser lido em: academic.oup.com/jid/advance-article-abstract/doi/10.1093/infdis/jiaf483/8261590.
Elton Alisson | Agência FAPESP